
Wesentliche Daten fehlen bei bedingter BioNTech/Pfizer Zulassung in EU
Was derzeit in der EU in Oberarme gespritzt wird, hat nur eine bedingte Marketing-Autorisierung. Die Zulassungsinhaber hatten und haben noch weitere Informationen beizubringen. Obwohl Pfizer/BioNTech bis Juli 2021 zwei wichtige ergänzende Informationen zu liefern gehabt hätten, fehlt hier noch immer einiges. Es handelt sich um zwei noch nie bei Menschen verwendete Inhaltsstoffe.
Dabei geht es um Lipide, die benötigt werden um die mRNA vor der Vernichtung durch das Immunsystem zu schützen und das Eindringen in die Körperzellen zu unterstützen. Die Firmen wie BioNTech, CureVac oder Moderna experimentieren damit seit Jahren beim Versuch Medikamente gegen Krebs zu entwickeln.
Bei der Anwendung als Medikament bei schwer an Krebs erkrankten Patienten sind akzeptable Verhältnisse von Risiko zu Nutzen gänzlich anders als für Impfstoffe, die gesunden Personen verabreicht werden. Deshalb sollte für eine bedingte Zulassung eine penible Risiko-Prüfung stattfinden.
Aber bevor wir in das Thema einsteigen, noch einen Überblick über bisher damit geimpfte Personen im Europäischen Wirtschaftsraum, sowie die bekannten Todesfälle und schweren unerwünschten Nebenwirkungen durch die Impfung mit Comirnaty:

Offene Fragen
Die Firma, die diese Lipide herstellt, schreibt auf ihrer Webseite: „ALC-0159 ist neben ALC-0315, DSPC und Cholesterin einer der Bestandteile des BNT162b2-Impfstoffs gegen SARS-CoV-2. Dieses Produkt ist nur für Forschungszwecke und nicht für den menschlichen Gebrauch bestimmt.“ Das hat einige Aufregung im Internet verursacht.
Die Firma will sich vermutlich nur gegen allfällige Ansprüche bei Problemen absichern und lehnt jede Verantwortung ab. Es müsste also von BioNTech/Pfizer sowie von der EMA besonders sorgfältig geprüft worden sein.
Auf ALC-0159 und ALC-0315 wird im EMA Assessment Report für die erste bedingte Marketing-Autorisierung ab Seite 22 eingegangen.
Es heißt dazu:
„Alle Hilfsstoffe außer den funktionellen Lipiden ALC-0315 und ALC-0159 und dem strukturellen Lipid DSPC entsprechen der Ph. Eur. Die funktionellen Lipide ALC-0315 und ALC-0159 werden als neuartige Hilfsstoffe eingestuft. Die beiden Strukturlipide DSPC und Cholesterin werden in mehreren bereits zugelassenen Fertigprodukten verwendet.“
Und weiter
„Das Fertigarzneimittel enthält zwei neuartige Hilfsstoffe, das kationische Lipid ALC-0315 und das PEGyliertes Lipid ALC-0159. Es werden nur begrenzte Informationen über die neuen Hilfsstoffe bereitgestellt.“
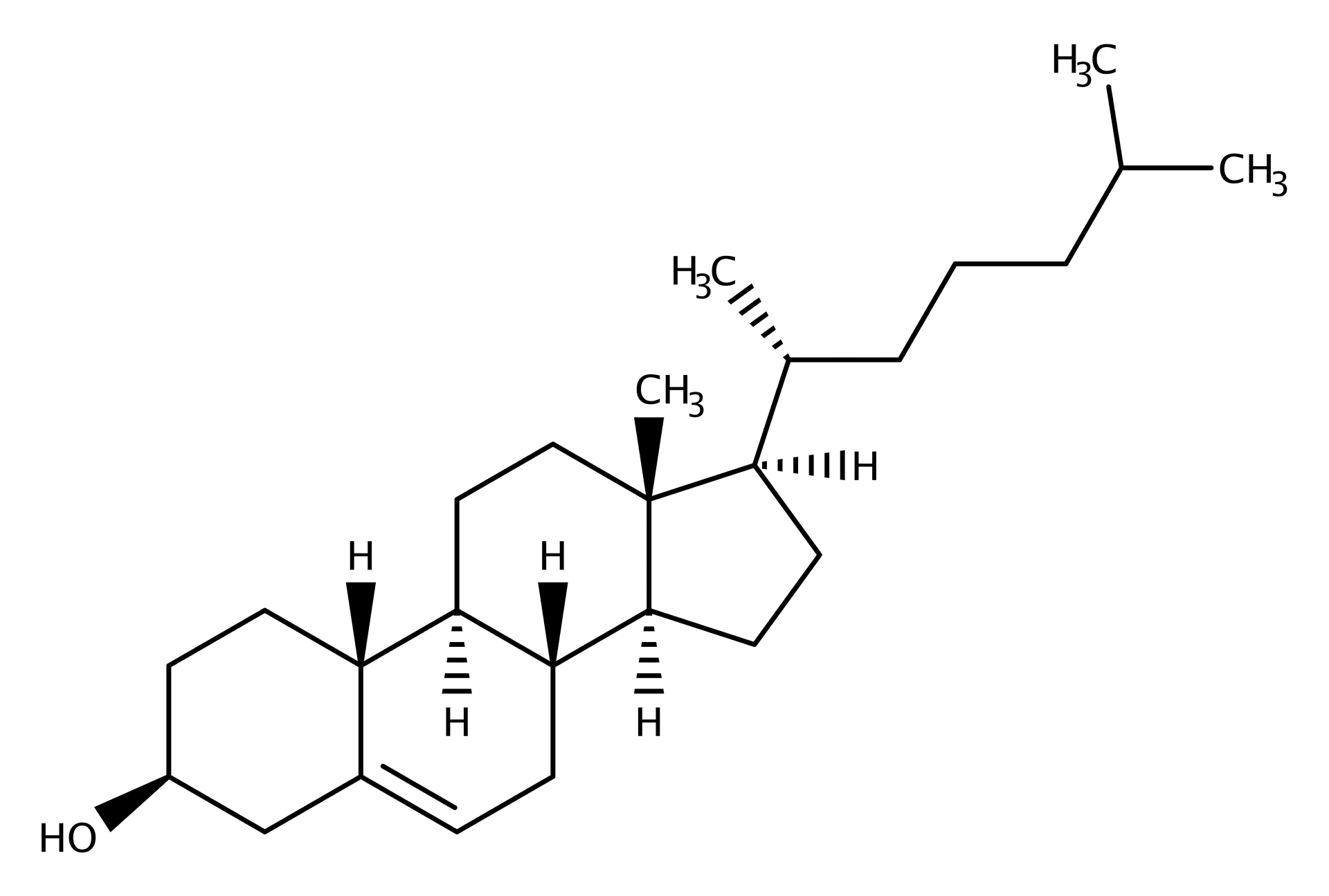
Das ist die Struktur des kationischen Lipids ALC-0315 ….

Insbesondere bei diesem kationischen Lipid wurden von vielen Biologen Bedenken geäußert.
… und hier die von ALC-0159

Durchgeführte Prüfungen
Auf Seite 45f finden sich Informationen über die Prüfung der beiden Lipide an Ratten:
„Die Konzentrationen von ALC-0315 und ALC-0159 in Plasma, Leber, Urin und Fäkalien wurden mittels LC-MS/MS zu verschiedenen Zeitpunkten bis zu 2 Wochen analysiert.
ALC-0315 und ALC-0159 wurden in den ersten 24 Stunden mit einer anfänglichen t½ von 1,62 bzw. 1,72 Stunden rasch aus dem Plasma ausgeschieden. 24 Stunden nach der Verabreichung waren weniger als 1 % der maximalen Plasmakonzentrationen vorhanden. Nach 24 Stunden wurde eine langsamere Clearance-Rate beobachtet, wobei die terminale Eliminationszeit von ALC-0315 und ALC-0159 bei 139 bzw. 72,7 Stunden lag. Nach der Plasmaclearance scheint die Leber das Hauptorgan zu sein, an das sich ALC-0315 und ALC-0159 verteilen. Der Antragsteller schätzt den prozentualen Anteil der in der Leber verteilten Dosis auf ~60% für ALC-0315 und ~20% für ALC-0159. Die beobachtete Verteilung in der Leber stimmt mit den Beobachtungen aus der Biodistributionsstudie und der Toxikologie bei wiederholter Verabreichung überein, die beide mit IM-Verabreichung durchgeführt wurden.
Bei ALC-0315 (Aminolipid) wurde die maximale Konzentration in der Leber (294 μg/g Leber) 3 Stunden nach der intravenösen Injektion erreicht. ALC-0315 wurde langsam aus der Leber eliminiert, und nach 2 Wochen betrug die Konzentration von ALC-0315 noch ~25 % der maximalen Konzentration, was darauf hindeutet, dass ALC-0315 in etwa 6 Wochen aus der Rattenleber eliminiert sein würde. Bei ALC-0159 (PEG-Lipid) wurde die maximale Konzentration in der Leber (15,2 μg/g Leber) 30 Minuten nach der Injektion erreicht.
ALC-0159 wurde schneller aus der Leber eliminiert als ALC-0315, und nach zwei Wochen betrug die Konzentration von ALC-0159 nur noch ~0,04 % der maximalen nachgewiesenen Konzentration. Der Antragsteller wurde gebeten, die lange Halbwertszeit von ALC-0315 und ihre Auswirkungen zu erörtern, den Vergleich mit Patisiran sowie die Auswirkungen auf die Boosts und die Dauer der Empfängnisverhütung nach der Behandlung zu diskutieren. Der Antragsteller vertrat die Auffassung, dass es auf der Grundlage der Studien zur Toxizität bei wiederholter Verabreichung bei Dosen (auf mg/kg-Basis), die weit über den beim Menschen verabreichten liegen, keine nichtklinischen Sicherheitsprobleme gibt; dies war für den CHMP akzeptabel.“
Wir sehen also, dass sich die Bestandteile des Präparats sehr rasch im ganzen Körper verteilen. In der Leber verbleibt ALC-0315 noch etwa 6 Wochen. Gemessen wurde das jedoch nicht, sondern nur errechnet. Soviel übrigens zu den Behauptungen es verbliebe alles an der Impfstelle im Oberarm, wie das auch der österreichische Gesundheitsminister Mückstein, ein Arzt, in einer Diskussion bei Servus TV meinte.
In einer detaillierten Aufstellung, die mir gemäß „Article 7 of Regulation (EC) No 1049/2001 regarding public access to European Parliament, Council and Commission documents (the Regulation) 1 and Section 3 of the Annex to the “European Medicines Agency policy on access to documents – POLICY/0043” 2 (the Agency Policy)“ zugegangen ist, finden sich die Details dazu. Hier die grafische Darstellung der Konzentration der beiden Lipide in der Leber von Ratten abhängig von der Zeit.

Wir sehen, dass sich insbesondere das Lipid ALC-0135 sehr lange im Blut und in der Leber hält. Der Abbau insbesondere in der Leber (Bild rechts) scheint extrem langsam zu gehen, er kommt nach etwa 3 Tagen praktisch zum Stillstand. Soviel zu den Behauptungen von Politikern, Gesundheitsbehörden und unwissenden Medien, dass die Impfstoffe rasch ausgeschieden werden.
Hier die beiden Dokumente zum nachlesen:
Auch weitere Untersuchungen und theoretische Berechnungen und Auswertungen sind im Bericht ausgeführt.
Die Auflagen
Für beide Stoffe wurden Auflagen zur Lieferung weiterer Informationen gegeben, nämlich SO4 und SO5 (SO = Specific Obligation). Was damit aufgetragen wurde und bis wann, finden wir auf Seite 36:

Hier die Übersetzung:
„Im Zusammenhang mit der bedingten Zulassung sollte der Antragsteller folgende Punkte erfüllen spezifische Verpflichtungen (SOs):
-
SO1: Um die Charakterisierung des Wirkstoffs und des Fertigerzeugnisses zu vervollständigen, sollte der Zulassungsinhaber zusätzliche Daten vorlegen. Fälligkeitsdatum: Juli 2021. Zwischenberichte: März 2021.
-
SO2: Um eine gleichbleibende Produktqualität zu gewährleisten, sollte der Zulassungsinhaber zusätzliche Informationen bereitstellen Informationen bereitstellen, um die Kontrollstrategie zu verbessern, einschließlich der Wirkstoff- und Produktspezifikationen. Fälligkeitsdatum: Juli 2021. Zwischenberichte: März 2021.
-
SO3: Um die Konsistenz des Herstellungsprozesses des Endprodukts zu bestätigen, sollte der MAH zusätzliche Validierungsdaten vorlegen. Fälligkeitsdatum: März 2021.
-
SO4: Zur Bestätigung des Reinheitsprofils und zur Gewährleistung einer umfassenden Qualitätskontrolle und Chargenkonsistenz während des gesamten Lebenszyklus des Endprodukts zu gewährleisten, sollte der Zulassungsinhaber zusätzliche Informationen über den Syntheseprozess und die Kontrollstrategie für den Hilfsstoff ALC-0315 vorlegen. Fälligkeitsdatum: Juli 2021, Zwischenberichte: Januar 2021, April 2021.
-
SO5: Zur Bestätigung des Reinheitsprofils und zur Gewährleistung einer umfassenden Qualitätskontrolle und des Endprodukts zu gewährleisten, sollte der Zulassungsinhaber zusätzliche Informationen über den zusätzliche Informationen über den Syntheseprozess und die Kontrollstrategie für den Hilfsstoff ALC-0159 vorlegen. Fälligkeitsdatum: Juli 2021, Zwischenberichte: Januar 2021, April 2021.“
Das wird dann auf den folgenden Seiten noch genauer im Details beschrieben, was an Informationen und Prüfungen zu liefern und durchzuführen ist.
Aktueller Status
Im Assessment Report für die Verlängerung um ein Jahr der bedingten Marketing-Autorisierung vom 3.11.2021 ist auf Seite 11 einiges über den Status der SOs zu lesen.
Bei SO4 betreffend ALC-0315 sowie SO5 betreffend ALC-0159 sind lediglich für Teilaspekte erfüllt, die meisten geforderten Untersuchungen sind noch ausständig. Laut Auflage hätten aber die entsprechenden Informationen und Daten bis Juli 2021 vorgelegt werden sollen.
Unter der „variation application EMEA/H/C/005735/II/0054/G“ wurden Informationen zu SO4 und SO5 geliefert. Wann genau das war, ist nicht feststellbar. Abgeschlossene „variation applications“ finden sich bereits mit Endnummern in den 70ern. Was fehlt und warum die Begutachtung noch läuft ist also leider nicht erkennbar.
Es fehlen somit nach wie vor wesentliche Daten und Informationen. Und damit will man ernsthaft eine Impfpflicht verhängen?
Eine endgültige Zulassung ist überhaupt erst denkbar, wenn die Zulassungsstudie abgeschlossen ist, die noch bis 2. Mai 2023 läuft. Auch alle „Specific Obligations“ müssten abgeschlossen und erfüllt sein.
Die Anwendung der Gentechnik-Präparate ist nur durch eine Ausnahme von der allgemeinen Gentechnik-Verordnung der EU möglich, die nur so lange gilt, wie es einen medizinischen Notfall gibt, also längst aufgehoben worden sein müsste. Es gibt wirkungsvollen Behandlungen, deshalb auch keinen Notfall mehr. Allerdings werden diese Behandlungen unter Inkaufnahme der Todesfälle unterdrückt und verleumdet.
Bild von isizawa auf Pixabay
Alle aktuellen News im TKP Telegram Channel
Unterstütze unabhängigen Journalismus mit einer Spende via PayPal
Status der Studien und bedingten Zulassung von Corona Impfstoffen in der EU
Forscher prangert Probleme mit der Datenintegrität bei Impfstoffstudie von Pfizer an
Fehlende Daten zur Impfstoffsicherheit – Experten Hearing im US-Senat
Negative Wirksamkeit einige Monate nach der Impfung in Studien